课时训练6 金属和金属材料
夯实基础
1.[2016·大连]有关金属的说法错误的是( )
A.铜制插头是利用铜的导电性
B.钨制灯丝是利用钨的熔点低
C.铝制成铝箔是利用铝的延展性
D.用铁锅炒菜是利用铁的导热性
2.[2016·南宁]有关合金的说法错误的是( )
A.钢是一种化合物
B.黄铜的硬度比纯铜的硬度大
C.生铁是一种铁的合金
D.焊锡的熔点比纯锡的熔点低
3.[2016·温州]为了验证"Fe、Cu、Ag三种金属的活动性由强到弱的顺序",小明设计了如图K6-1所示的实验,其中可以达到实验目的的组合是( )
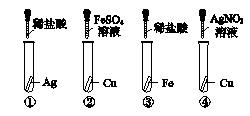
图K6-1
A.①② B.①③ C.②④ D.③④
4.[2017·广安]下列现象和事实,可用金属活动性作出合理解释的是( )
①相同的金属镁、铝分别与相同浓度的稀盐酸反应,镁反应更剧烈,说明镁比铝的金属活动性强 ②用硫酸铜、石灰水配制农药波尔多液时,不能用铁制容器盛放 ③尽管金属的种类很多,但在自然界中,仅有少数金属(银、铂、金)以单质形式存在 ④金属铝比金属锌更耐腐蚀,说明锌比铝的金属活动性强
A.①②③ B.①②
C.③④ D.①②③④
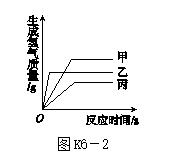
图K6-2
5.[2017·泰安]现有等质量甲、乙、丙三种金属,分别放入三份溶质质量分数相同的足量稀硫酸中,产生氢气的质量与反应时间的关系如图K6-2所示(已知甲、乙、丙在生成物中化合价均为+2),则下列说法中不正确的是( )
A.生成氢气的质量:甲>乙>丙
B.相对原子质量:乙>丙>甲
C.金属活动性:乙>甲>丙
D.消耗硫酸的质量:甲>乙>丙
6.有一不纯的铁,含有镁、铝、锌3种杂质中的2种,取该样品2.8 g与足量的稀硫酸反应,得到0.1 g氢气,则这种铁一定含有的杂质是( )
A.锌 B.镁 C.铝 D.锌和铝
7.[2017·绥化]某化学兴趣小组将一定质量的镁粉加入到硝酸银和硝酸亚铁的混合溶液中,充分反应后过滤,得到滤液和滤渣,向滤渣中滴加稀盐酸有气泡产生,下列判断正确的是( )
A.滤液中一定不含硝酸银和硝酸亚铁
B.滤液中一定含有硝酸镁和硝酸亚铁
C.滤渣中一定含有铁和银,可能含有镁
D.滤渣中一定含有镁、铁和银
8.钢铁是生活中使用最多的金属材料。如图K6-3为实验室炼铁的装置图。
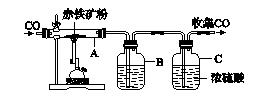
图K6-3
(1)实验过程中,先要进行的是________(填"Ⅰ"或"Ⅱ")。
Ⅰ.加热 Ⅱ.通一氧化碳
(2)A中可观察到的现象是________变为黑色,此反应的化学方程式为____________________________;将反应后的气体通过装置B和C,收集较纯净的CO并循环使用,B中应盛放的试剂是________浓溶液。
(3)有同学提出:灼烧可使钢中的碳转化为二氧化碳,钢样品的质量会减轻。但是他们将一定量的钢样品灼烧后,发现质量反而增加了,其原因是________________________________________________________________________。
能力提升
1.在托盘天平两边各放一只烧杯,在两只烧杯里注入相同质量、相同质量分数的稀盐酸,天平平衡,然后分别放入质量相等的镁和铝。待充分反应后,镁有剩余,则还可以观察到的实验现象是( )
①天平保持平衡 ②铝也有剩余 ③天平指针偏向放镁的一边 ④天平指针偏向放铝的一边
⑤铝完全溶解
A.②③ B.①② C.①⑤ D.④⑤
2.[2017·南充]下列图像能正确反映对应变化关系的是( )
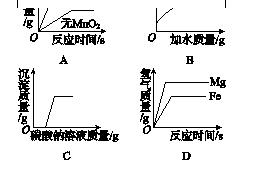
图K6-4
A.两份等质量的氯酸钾在有、无MnO2的情况下加热产生氧气
B.加水稀释浓盐酸
C.向稀盐酸和氯化钙的混合溶液中加入碳酸钠溶液
D.将足量粉末状的铁和镁分别与等质量、等质量分数的稀盐酸反应
3.往硝酸铜、硝酸银和硝酸亚铁的混合溶液中缓慢连续加入质量为m的锌粉,溶液中析出固体的质量与参加反应的锌粉质量关系如图K6-5所示,下列说法中正确的是( )
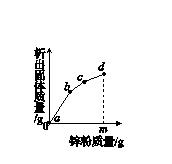
图K6-5
A.c点对应溶液中含有的金属离子为Zn2+和Cu2+
B.bc段(不含两端点)析出的金属是Fe
C.ab段(不含两端点)对应溶液中含有的金属离子为Zn2+、Ag+、Cu2+、Fe2+
D.若bc段和cd段中析出固体质量相等,参加反应的锌粉质量分别为m1和m2,m1>m2
4.[2017·聊城]某化学小组的同学,为了比较金属R与铁、铜的金属活动性强弱,进行如下探究活动。
[查阅资料] 铁的活动性比铜强。
[进行猜想] 对三种金属的活动性顺序作出如下猜想:
猜想一:R>Fe>Cu;猜想二:______________;猜想三:Fe>Cu>R。
[收集证据] 为了验证哪一种猜想成立,甲、乙、丙三位同学分别展开实验探究。
写出铁丝在氧气中燃烧的化学方程式:______________________________。
[交流反思] 三位同学交流讨论后认为,比较金属活动性强弱的方法有多种。
[归纳总结] 他们总结得出比较金属活动性强弱的常见方法有:
(1)金属与氧气反应的难易和剧烈程度;
(2)金属与酸溶液是否反应或反应的剧烈程度;
(3)金属与______________是否反应。
5.中国的铁锅作为一种健康炊具,在世界备受欢迎。请回答下列问题。
(1)铁锅为什么会生锈?
(2)使用完铁锅后如何防止生锈?(答一点即可)
(3)废弃铁锅回收利用的意义是什么?(答一点即可)
参考答案
夯实基础
1.B [解析] 钨制灯丝是利用钨的熔点比较高的特性。
2.A [解析] 钢是铁的合金,属于混合物。
3.C [解析] ①中银不能与稀盐酸反应,说明银的金属活动性比氢弱;②中铜不能与硫酸亚铁溶液反应,说明铜的金属活动性比铁弱;③中铁能与稀盐酸反应,说明铁的金属活动性比氢强;④中铜能与硝酸银溶液反应,说明铜的金属活动性比银强。综合以上分析可知,②④的组合即可判断Fe、Cu、Ag三种金属的活动性由强到弱的顺序。
4.A [解析] 金属的位置越靠前,与酸反应越剧烈,镁与稀盐酸反应比铝与稀盐酸反应剧烈,说明镁的活动性比铝强;铁位于铜的前面,可以将铜置换出来;活动性强的金属易和氧气反应,根据金属在自然界中的存在形态可以判断出金属活动性强弱;铝的表面有一层致密的氧化膜,能阻止氧气与里层的铝反应,所以铝有很强的耐腐蚀性,但是铝比锌活泼。
5.B [解析] 由图可知,三种金属完全反应后生成氢气的质量大小是:甲>乙>丙;由题意可知,甲、乙、丙在生成物中化合价相同,生成氢气质量与金属的相对原子质量成反比,则三种金属的相对原子质量大小是:丙>乙>甲;金属越活泼,反应越迅速,消耗的时间越短,则三种金属的活动性顺序为:乙>甲>丙;生成的氢气质量与消耗的硫酸质量成正比,所以消耗硫酸的质量大小是:甲>乙>丙。
6.A
7.C [解析] 将镁加入到硝酸银和硝酸亚铁的混合溶液中,镁先和硝酸银反应生成硝酸镁和银,然后镁再和硝酸亚铁反应生成硝酸镁和铁;向反应后的滤渣中加入稀盐酸有气泡生成,则说明滤渣中一定含有银和铁,可能含有镁,而滤液中一定含有硝酸镁,可能含有硝酸亚铁。
8.(1)Ⅱ (2)红棕色粉末
3CO+Fe2O3
(3)钢中含碳量少,所以碳减少的质量远小于铁转化为氧化物时增加的质量
[解析] (1)一氧化碳和空气的混合物点燃,可能发生爆炸,所以实验过程中,先要进行的是Ⅱ;
(2)一氧化碳和氧化铁在高温的条件下反应生成铁和二氧化碳,化学方程式为3CO+Fe2O3
(3)钢在灼烧时,由于含碳量较小,减少的质量会远小于铁转化为氧化物增加的质量,因此灼烧后质量反而增加。
能力提升
1.B [解析] 根据计算知,消耗相同质量的盐酸需要镁和铝的质量比为12∶9,由题意知,充分反应后镁有剩余,可推知铝也有剩余,金属相对酸来说均过量,两者生成的气体质量相等,所以天平仍然平衡。
2.C [解析] 两份氯酸钾质量相等,所以最终产生氧气的质量相等,加MnO2的,产生氧气速率快,先反应完;加水稀释浓盐酸,pH不断增大,无限接近于7,但它仍是酸溶液,pH永远小于7,不会等于7,更不会大于7;碳酸钠先与稀盐酸反应,所以,一开始没有沉淀产生,稀盐酸被完全反应后,氯化钙才与碳酸钠反应,生成碳酸钙沉淀,当氯化钙完全反应后,沉淀质量不再增加;金属足量,稀盐酸质量、质量分数相等,最终,产生氢气的质量相等,而镁比铁活泼,镁先反应完。
3.C [解析] 四种金属的活动性锌>铁>铜>银,活动性强的金属可以把活动性弱的金属从其盐溶液中置换出来,在反应中,最不活泼的金属最先析出,以此类推,最活泼的金属留在溶液中,所以由图示可知,ab段析出的金属是银,bc段析出的金属是铜,cd段析出的金属是铁,所以c点状态时金属铜完全析出,溶液中含有的金属离子还有Zn2+和Fe2+;bc段(不含两端点)析出的金属是Cu;ab段(不含两端点)析出的金属是银,溶液中含有的金属离子还有Zn2+、Ag+、Cu2+、Fe2+;Zn+Fe(NO3)2===Zn(NO3)2+Fe
65 56
Zn+Cu(NO3)2===Zn(NO3)2+Cu
65 64
由化学方程式中等质量的锌完全反应置换出铜的质量多于铁可知,当置换出相等质量的铜和铁时消耗的锌的质量是铁多于铜,所以m1<m2。
4.[进行猜想] Fe>R>Cu
[收集证据] R丝表面有红色物质析出 快
不能燃烧 3Fe+2O2
[归纳总结] 盐溶液
[解析] [进行猜想] 铁的金属活动性比铜强,由于不知道R是哪种金属,所以R的金属活动性可能比铁、铜强,也可能比铁、铜弱。
[收集证据] 由实验结论猜想一:R>Fe>Cu正确可知R的金属活动性大于铜,所以R丝插入硫酸铜溶液中,能把铜置换出来,故可看到R丝表面有红色物质析出;因为R比Fe活泼,所以R与盐酸反应比铁与盐酸反应剧烈,产生气泡速率快;空气中氧气的浓度低,铁在空气中不能燃烧,铁可在氧气中燃烧。
5.(1)铁与水和氧气同时接触(或铁与空气中的水蒸气和氧气同时接触)。
(2)保持铁锅表面洁净干燥;洗净擦干(其他答案合理也可)。
(3)节约金属资源;保护环境(或减少环境污染);节约能源(或减少能源消耗);节约资金。
PAGE


